Soal dan Penyelesaian Menghitung pH asam dan Basa Lemah
Soal 1
Asam lemah berikut yang termasuk asam lemah triprotik adalah . . . .
A. HF
C.
D.
E.
Pembahasan :
Nah dari penejelasan ini sudah diketahui bahwa asam lemah triprotik dari option soal diatas adalah .
.
Jawaban : E
Soal 2
Suatu asam lemah mempunyai harga tetapan ionisasi sebesar
mempunyai harga tetapan ionisasi sebesar  . Jika konsentrasi asam tersebut adalah 0,02 M, maka pH larutan asam tersebut adalah . . . .
. Jika konsentrasi asam tersebut adalah 0,02 M, maka pH larutan asam tersebut adalah . . . .
A. 2 - log 3
B. 3 - log 2
C. 4 - log 5
D. 4 - log 6
E. 5 - log 6
Pembahasan :
Yang diketahui adalah :
Tetapan ionisasi = Ka =
M asam lemah = 0,02 M = M
M
Rumus untuk mementukan konsentrasi H+ dari asam lemah :
![\small [H^{+}] = \sqrt{Ka \: x \: M}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{Ka&space;\:&space;x&space;\:&space;M})
![\small [H^{+}] = \sqrt{1,8 x 10^{-5} \: x \: 2 x 10^{-2}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1,8&space;x&space;10^{-5}&space;\:&space;x&space;\:&space;2&space;x&space;10^{-2}})
![\small [H^{+}] = \sqrt{3,6 x 10^{-7}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{3,6&space;x&space;10^{-7}})
![\small [H^{+}] = \sqrt{36 x 10^{-8}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{36&space;x&space;10^{-8}})
![\small [H^{+}] = 6 x 10^{-4}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;6&space;x&space;10^{-4})
Setelah dapat [H+] barulah kita cari pH dengan menggunakan rumus :
pH = - log [H+]
= - log
= 4 - log 6
Jawaban : D
Soal 3
Tabel dibawah ini memperlihatkan harga Ka untuk 3 buah jenis asam lemah bervalensi satu.
No Nama Asam Konsentrasi Ka
1 Asam asetat 0,1 M
2. Asam benzoat 0,1 M
3. Asam fluorida 0,1 M
Berdasarkan data diatas, urutan kekuatan asam dari yang terlemah ditunjukkan oleh nomor . . . . .
A. 1 - 2 - 3
B. 1 - 3 - 2
C. 2 - 1 - 3
D. 3 - 1 - 2
E. 3 - 2 - 1
Pembahasan :
Misalkan saja ada suatu asam lemah HA yang mengion sebagai berikut :
HA(aq)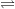 H+(aq) + A-(aq)
H+(aq) + A-(aq)
Maka rumus Ka nya dapat kita buat sebagai berikut :
![\small Ka = \frac{[H^{+}][A^{-}]}{[HA]}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;Ka&space;=&space;\frac{[H^{+}][A^{-}]}{[HA]})
Asam semakin kut ditandai dengan jumlah ion H+ yang dihasilkan semakin banyak. Untu asam lemah, masing masing asamnya menghasilkan ion H+ yang berbeda beda. Semakin banyak ion H+nya maka tentu semakin kuat asam lemah itu. Jika ion H+ yang dihasilkan semakin banyak maka reaksi kesetimbangan akan bergeser kearah pembentunkan ion H+ dan A- lebih banyak. Akibatnya adalah nilai Ka nya akan semakn besar.
Kesimpulan : Ka >>>> ==> Asam lemahnya semakin kuat
Nah untuk soal diatas urutan kekuatan asam dari yang terlemah adalah 3 - 2 - 1.
Jawaban : E
Soal 4
Suatu asam lemah HX dengan konsentrasi 0,1 M dan harga =
=  . Harga tetapan kesetimbangan dan konsentrasi ion H+ secara berturut turut adalah . . . . .
. Harga tetapan kesetimbangan dan konsentrasi ion H+ secara berturut turut adalah . . . . .
A.
B.
C.
D.
E.
Pembahasan :
Pertama kita cari dulu harga Ka jika diketahui alfa ( ) nya dengan menggunakan rumus :
) nya dengan menggunakan rumus :



^{2}\:&space;x\:&space;0,1)

Nah setelah itu baru kita dapat mencari harga konsentrasi ion H+ nya
![\small [H^{+}] = \sqrt{Ka \: x \: M}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{Ka&space;\:&space;x&space;\:&space;M})
![\small [H^{+}] = \sqrt{1 x 10^{-3}\: x \: 1 x 10^{-1}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1&space;x&space;10^{-3}\:&space;x&space;\:&space;1&space;x&space;10^{-1}})
![\small [H^{+}] = \sqrt{1 x 10^{-4}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1&space;x&space;10^{-4}})
![\small [H^{+}] = 1 x 10^{-2}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;1&space;x&space;10^{-2}) M
M
Jawaban : C
Soal 5
Suatu basa emah NH4OH mempunyai konsentrasi 0,5 M dan terionisasi sebanyak 10%. Harga pOH dan pH secara berturut turut adalah . . . .
A. 1 - log 2 dan 13 + log 2
B. 2 - log 5 dan 12 + 1og 5
C. 3 - log 4 dan 11 + log 4
D. 4 - log 6 dan 10 + log 6
E. 5 - log 3 dan 9 + log 3
Pembahasan :
Jika NH4OH terionisasi sebanya 10 % maka nilai = 0,1.
= 0,1.
Ada dua cara mencari pOH dan pH nya yaitu dengan mencari Ka terlebih dahulu menggunakan rumus :

Atau langsung cari [H+] menggunakan rumus berikut :

Kita gunakan saja rumus kedua ini, karena lebih cepat.
![\small [OH^{-}] = M\: x \: \alpha](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[OH^{-}]&space;=&space;M\:&space;x&space;\:&space;\alpha)

=
pOH = - log [OH-]
= - log
= 2 - log 5
pH = 14 - pOH
= 14 - (2 - log 5)
= 12 + log 5
Jawaban : B
Asam lemah berikut yang termasuk asam lemah triprotik adalah . . . .
A. HF
B. HCN
C.
Baca Juga
E.
Pembahasan :
Asam lemah triprotik adalah asam lemah yang melepaskan 3 buah ion H+ dalam air. Uintuk menentukan mana asam yang triprotik adalah dengan melihat jumlah H yang dimiliki oleh asam tersebut dimana untuk asam yang megandung 3 buah atom H adalah asam tiprotik,
Nah dari penejelasan ini sudah diketahui bahwa asam lemah triprotik dari option soal diatas adalah
Jawaban : E
Soal 2
Suatu asam lemah
A. 2 - log 3
B. 3 - log 2
C. 4 - log 5
D. 4 - log 6
E. 5 - log 6
Pembahasan :
Yang diketahui adalah :
Tetapan ionisasi = Ka =
M asam lemah = 0,02 M =
Rumus untuk mementukan konsentrasi H+ dari asam lemah :
Setelah dapat [H+] barulah kita cari pH dengan menggunakan rumus :
pH = - log [H+]
= - log
= 4 - log 6
Jawaban : D
Soal 3
Tabel dibawah ini memperlihatkan harga Ka untuk 3 buah jenis asam lemah bervalensi satu.
No Nama Asam Konsentrasi Ka
1 Asam asetat 0,1 M
2. Asam benzoat 0,1 M
3. Asam fluorida 0,1 M
Berdasarkan data diatas, urutan kekuatan asam dari yang terlemah ditunjukkan oleh nomor . . . . .
A. 1 - 2 - 3
B. 1 - 3 - 2
C. 2 - 1 - 3
D. 3 - 1 - 2
E. 3 - 2 - 1
Pembahasan :
Misalkan saja ada suatu asam lemah HA yang mengion sebagai berikut :
HA(aq)
Maka rumus Ka nya dapat kita buat sebagai berikut :
Asam semakin kut ditandai dengan jumlah ion H+ yang dihasilkan semakin banyak. Untu asam lemah, masing masing asamnya menghasilkan ion H+ yang berbeda beda. Semakin banyak ion H+nya maka tentu semakin kuat asam lemah itu. Jika ion H+ yang dihasilkan semakin banyak maka reaksi kesetimbangan akan bergeser kearah pembentunkan ion H+ dan A- lebih banyak. Akibatnya adalah nilai Ka nya akan semakn besar.
Kesimpulan : Ka >>>> ==> Asam lemahnya semakin kuat
Nah untuk soal diatas urutan kekuatan asam dari yang terlemah adalah 3 - 2 - 1.
Jawaban : E
Soal 4
Suatu asam lemah HX dengan konsentrasi 0,1 M dan harga
A.
B.
C.
D.
E.
Pembahasan :
Pertama kita cari dulu harga Ka jika diketahui alfa (
Nah setelah itu baru kita dapat mencari harga konsentrasi ion H+ nya
Jawaban : C
Soal 5
Suatu basa emah NH4OH mempunyai konsentrasi 0,5 M dan terionisasi sebanyak 10%. Harga pOH dan pH secara berturut turut adalah . . . .
A. 1 - log 2 dan 13 + log 2
B. 2 - log 5 dan 12 + 1og 5
C. 3 - log 4 dan 11 + log 4
D. 4 - log 6 dan 10 + log 6
E. 5 - log 3 dan 9 + log 3
Pembahasan :
Jika NH4OH terionisasi sebanya 10 % maka nilai
Ada dua cara mencari pOH dan pH nya yaitu dengan mencari Ka terlebih dahulu menggunakan rumus :
Atau langsung cari [H+] menggunakan rumus berikut :
Kita gunakan saja rumus kedua ini, karena lebih cepat.
=
pOH = - log [OH-]
= - log
= 2 - log 5
pH = 14 - pOH
= 14 - (2 - log 5)
= 12 + log 5
Jawaban : B
Tags:
kimia






