Contoh Soal Menentukan persamaan laju reaksi
Contoh Soal Menentukan persamaan laju reaksi - Pada topik sebelumnya, kalian telah mempelajari faktor-faktor yang mempengaruhi laju reaksi. Pada topik ini, kalian akan mempelajari cara menentukan persamaan laju reaksi.
v = k[A]m[B]n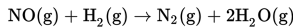
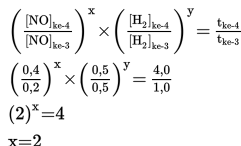
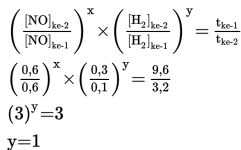

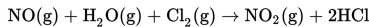
Menentukan Persamaan Laju Reaksi
Mari kita ingat kembali faktor-faktor yang mempengaruhi laju reaksi.
1. Faktor-Faktor yang Mempengaruhi Laju Reaksi
a. Konsentrasi Pereaksi
Semakin besar konsentrasi pereaksi, maka laju reaksinya akan semakin cepat karena semakin banyak partikel yang bertumbukan. Sebaliknya jika konsentrasi pereaksinya semakin kecil, maka laju reaksinya akan menjadi semakin lambat karena pertikel yang bertumbukan juga semakin sedikit.
b. Suhu
c. Luas Permukaan Bidang Sentuh
d. Katalis
Penambahan katalis dapat mempercepat laju reaksi dengan cara menurunkan energi aktivasi.
1. Faktor-Faktor yang Mempengaruhi Laju Reaksi
Faktor-faktor yang mempengaruhi laju reaksi ada 4, yaitu sebgai berikut.
a. Konsentrasi Pereaksi
Baca Juga
b. Suhu
Semakin tinggi suhu, maka laju reaksinya akan semakin cepat karena energi kinetik partikel akan meningkat seiring peningkatan suhu. Semakin rendah suhu, maka laju reaksinya akan semakin lambat.
c. Luas Permukaan Bidang Sentuh
Semakin besar luas permukaan bidang sentuh, semakin banyak partikel yang bertumbukan. Semakin kecil luas permukaan bidang sentuh, semakin sedikit partikel yang bertumbukan.
d. Katalis
Penambahan katalis dapat mempercepat laju reaksi dengan cara menurunkan energi aktivasi.
2. Menentukan Persamaan Laju Reaksi
Persamaan laju reaksi terbentuk dari hukum laju reaksi. Hukum laju reaksi dihasilkan dari pengukuran laju reaksi berbagai eksperimen yang menunjukkan fungsi konsentrasi zat-zat pereaksinya. Hukum laju reaksi dinyatakan dalam bentuk persamaan berikut.
Persamaan laju reaksi terbentuk dari hukum laju reaksi. Hukum laju reaksi dihasilkan dari pengukuran laju reaksi berbagai eksperimen yang menunjukkan fungsi konsentrasi zat-zat pereaksinya. Hukum laju reaksi dinyatakan dalam bentuk persamaan berikut.
Persamaan Laju Reaksi
v = k[A]m[B]n
Keterangan:
v = laju reaksi (mol.L-1.s-1);
k = tetapan laju reaksi; dan
m,n = orde reaksi (bilangan pangkat yang menyatakan besarnya pengaruh konsentrasi A, B terhadap laju reaksi.
v = laju reaksi (mol.L-1.s-1);
k = tetapan laju reaksi; dan
m,n = orde reaksi (bilangan pangkat yang menyatakan besarnya pengaruh konsentrasi A, B terhadap laju reaksi.
Untuk memahami cara menentukan persamaan laju reaksi, mari kita lihat contoh berikut ini.
Contoh Soal
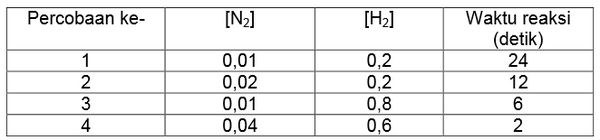
Nitrogen monoksida direaksikan dengan gas hidrogen mengikuti persamaan berikut ini.
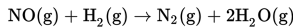
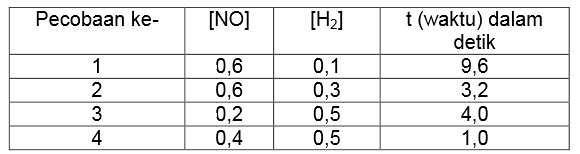
Dari reaksi tersebut diperoleh data sebagai berikut.

Berdasarkan data percobaan tersebut, tentukan persamaan laju reaksinya!
Penyelesaian
Langkah-langkah menentukan persamaan laju reaksi jika diketahui konsentrasi pereaksi dan waktu.
a. Menentukan orde rekasi NO (simbolkan x)
Untuk menentukan orde rekasi NO, maka cari dua percobaan dengan konsentrasi H2 sama (percobaan 3 dan 4). Bandingkan konsentrasi pada percobaan 3 dan 4 dengan waktu sesuai persamaan berikut ini.
Langkah-langkah menentukan persamaan laju reaksi jika diketahui konsentrasi pereaksi dan waktu.
a. Menentukan orde rekasi NO (simbolkan x)
Untuk menentukan orde rekasi NO, maka cari dua percobaan dengan konsentrasi H2 sama (percobaan 3 dan 4). Bandingkan konsentrasi pada percobaan 3 dan 4 dengan waktu sesuai persamaan berikut ini.
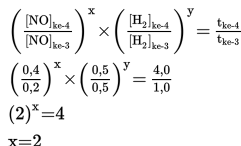
Jadi orde reaksi NO adalah 2.
b. Menentukan orde reaksi H2 (simbolkan y)
Untuk menentukan orde rekasi H2, maka cari dua percobaan dengan konsentrasi NO sama (percobaan 1 dan 2). Bandingkan konsentrasi pada percobaan 1 dan 2 dengan waktu sesuai persamaan berikut ini.
Untuk menentukan orde rekasi H2, maka cari dua percobaan dengan konsentrasi NO sama (percobaan 1 dan 2). Bandingkan konsentrasi pada percobaan 1 dan 2 dengan waktu sesuai persamaan berikut ini.
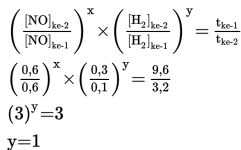
Jadi orde reaksi H2 adalah 1.
c. Menuliskan persamaan laju reaksi v = k[NO]2[H2].

S1
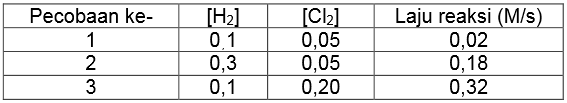
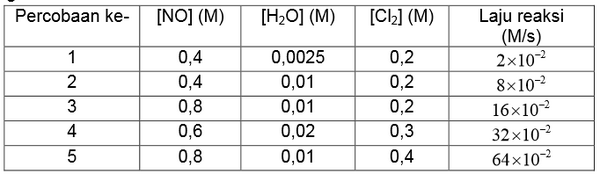
Data percobaan untuk reaksi H2 (g) + Cl2 (g) → 2 HCl (l) adalah sebagai berikut.

Berdasarkan data tersebut, persamaan laju reaksinya adalah....
S2
Pada suhu tertentu, gas brom (Br2) direaksikan dengan gas nitrogen monoksida (NO) sesuai persamaan berikut.
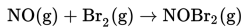
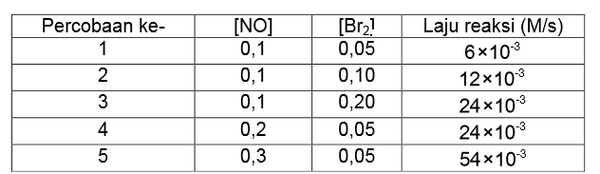
Dari reaksi tersebut diperoleh data sebagai berikut.

Berdasarkan data percobaan tersebut, persamaan laju reaksinya adalah....
S3
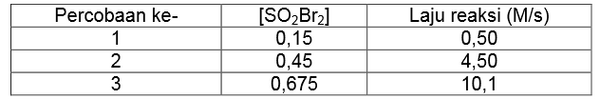
Sulfur bromida (SO2Br2) dapat terurai menjadi SO2 dan Br2 sesuai persamaan reaksi berikut.
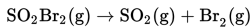
Reaksi tersebut menghasilkan data-data berikut.

Persamaan laju reaksi untuk kondisi tersebut adalah....
S4
Data percobaan reaksi N2(g) + O2(g) → 2NO(g) adalah sebagai berikut.

Berdasarkan data tersebut, persamaan laju reaksinya adalah....
S5
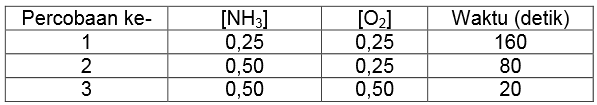
Percobaan untuk reaksi antara amonia dan oksigen menghasilkan data sebagai berikut.

Berdasarkan data tersebut, persamaan laju reaksinya adalah….
S6
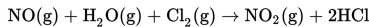
Reaksi di atas menghasilkan data percobaan sebagai berikut.

Berdasarkan data percobaan tersebut, persamaan laju reaksinya adalah….
S7
Pada reaksi 2SO2(g) + O2(g) → 2SO3(g), diperoleh:
1. bila konsentrasi awal SO2 dinaikan menjadi dua kali pada konsentrasi O2 yang tetap, laju reaksi menjadi dua kali lebih besar; dan
2. bila konsentrasi awal SO2 dan O2 masing-masing dinaikan menjadi dua kali, laju reaksi menjadi delapan kali lebih besar.
Berdasarkan data tersebut, laju reaksinya adalah....
1. bila konsentrasi awal SO2 dinaikan menjadi dua kali pada konsentrasi O2 yang tetap, laju reaksi menjadi dua kali lebih besar; dan
2. bila konsentrasi awal SO2 dan O2 masing-masing dinaikan menjadi dua kali, laju reaksi menjadi delapan kali lebih besar.
Berdasarkan data tersebut, laju reaksinya adalah....
S8
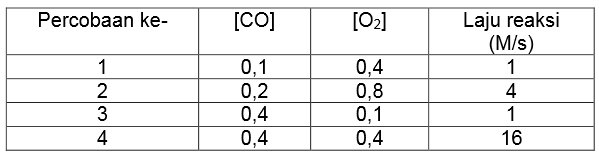
Reaksi antara gas karbon monoksida (CO) dan oksigen (O2) menghasilkan data percobaan sebagai berikut.

Berdasarkan data tersebut, persamaan laju reaksinya adalah….
S9
Reaksi penguraian NOCl2 → NO + Cl berlangsung selama 30 detik. Jika konsentrasi NOCl2 dinaikan dua kali, maka reaksi menjadi berlangsung selama 7,5 detik. Berdasarkan data tersebut, persamaan laju reaksinya adalah....
S10
Dalam suatu reaksi, jika konsentrasi N2 diperkecil menjadi 0,5 kali semula dan konsentrasi H2 tetap, maka laju reaksinya menjadi 0,25 kalinya. Sementara itu, jika konsentrasi H2 diperbesar menjadi 2 kali semula pada konsentrasi N2 tetap, laju reaksinya menjadi 8 kalinya. Persamaan laju reaksi dari kondisi tersebut adalah….
Tags:
Contoh Soal Kimia







