Contoh Soal Larutan cair
Contoh Soal Larutan cair - Dalam larutan, zat yang sedang terlarut adalah zat terlarut dan zat yang melarutkan adalah Pelarut. Biasanya zat terlarut hadir dalam jumlah kecil dari pelarut. Jika air digunakan sebagai pelarut, maka itu adalah larutan cair

Elektrolit
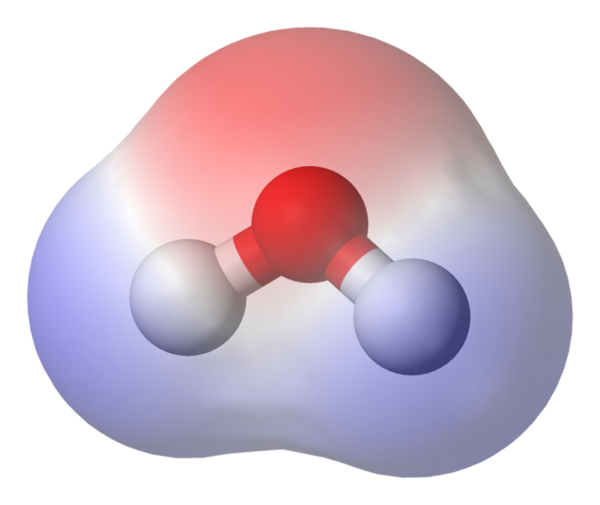
Ketika zat terlarut berdisosiasi berpisah dalam air untuk membentuk ion, maka akan menjadi elektrolit. Asam, basa dan garam adalah contoh dari elektrolit. Semuanya menghantarkan listrik karena gerakan ion positif dan negatif. Oleh karena itu ion adalah pembawa muatan dalam larutan, berbeda dengan logam dimana elektron adalah pembawa muatan.
Beberapa zat sepenuhnya (100%) ter-ionisasi ketika dilarutkan dalam air. Ini berarti bahwa akan sepenuhnya larut dalam air dan tidak ada molekul netral yang tersisa dalam larutan. Zat ini dikatakan elektrolit kuat Asam kuat dan basa dan garam anorganik terlarut adalah elektrolit kuat. Contoh: Asam klorida, asam nitrat, sodium klorida
HCl → H+ + Cl-
NaCl → Na+ + Cl-
Beberapa zat yang tidak sepenuhnya terionisasi (biasanya kurang dari 1%) saat dilarutkan dalam air. Larutan ini mengandung sedikit ion dan molekul bermuatan (biasanya berjumlah lebih besar dari 99%) juga hadir dalam larutan ini. Zat ini dikatakan Elektrolit lemah. Asam lemah dan basa adalah elektrolit lemah. Contoh: Asam karbonat, asam asetat
H2CO3 → H+ + HCO3- (<1%)
CH3COOH → H+ + CH3COO- (<1%)
Non-elektrolit
Beberapa zat larut dalam air, tetapi mereka tidak berpisah untuk membentuk ion. Zat ini tidak menghasilkan larutan elektrolit dan disebut non-elektrolit. Contoh: gula dan etanol
Apa yang bisa dan tidak larut dalam air?
Dikenal sebagai pelarut universal, salah satu sifat yang paling penting dari air adalah kemampuannya untuk melarutkan berbagai zat. Hal ini tidak sepenuhnya benar karena air tidak akan bisa melarutkan minyak dan molekul hidrokarbon terantai lainnya, tetapi memang mampu untuk melarutkan banyak zat terlarut yang berbeda.
Air adalah molekul polar yang berarti salah satu ujung molekul memiliki muatan positif dan ujung lainnya memiliki muatan negatif, sehingga air adalah pelarut polar, pelarut polar yang paling baik.

Aturan umum dari larutan adalah, Saling bercampur (“Like dissolves like”) dengan demikian berarti larutan polar dan ion akan larut dalam pelarut polar. Contoh: garam dan air dan etanol dan air. larutan non-polar yang larut dalam pelarut non-polar. Tapi minyak non-polar tidak akan mudah larut dalam air polar. Gula dan etanol larut sepenuhnya dalam air karena mereka adalah molekul polar seperti air dan mampu mengikat molekul air dengan kuat.
Dengan kata molekul lain yang dapat memisahkan menjadi komponen-komponen yang memiliki muatan positif dan negatif atau molekul polar akan larut dalam air. Sebagai contoh, NaCl bisa memisahkan diri menjadi Na+ dan Cl- ion dan karena itu larut dalam air. Molekul tanpa karakteristik ini tidak akan larut dalam air. Contoh: Minyak, karbon tetraklorida.
Kelarutan alkohol
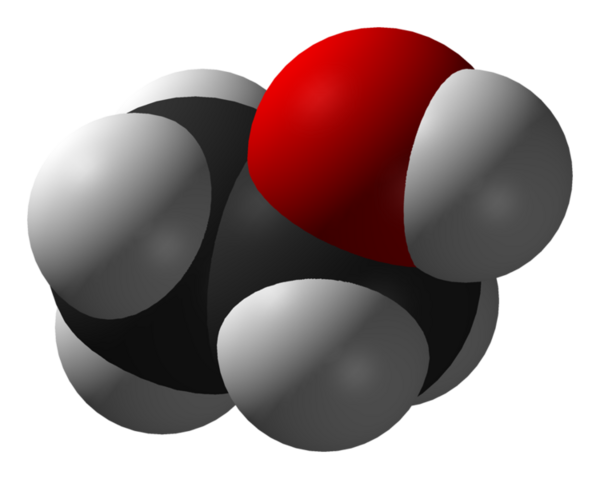
Aturan umum dari larutan, Saling bercampur (“Like dissolves like”) agak rumit jika diterapkan pada alkohol. Alkohol terdiri dari kumpulan-OH yang polar dan rantai hidrokarbon yang non-polar. Ketika etanol dan air dicampur, air yang polar menarik kelompok -OH. Tapi akan menolak rantai hidrokarbon non-polar. Kelarutan alkohol ditentukan oleh siapa yang paling kuat dari dua kekuatan yang berbeda. Karena kekuatan tarik kelompok-OH, tiga alkohol yang pertama - metanol, etanol dan propanol yang larut (100% larut) dalam air. Kelarutan alkohol menurun mulai dari empat karbon - butanol. Dari kedelapan alkohol-oktanol, akan benar-benar larut dalam air.

Ethanol, CH 3 CH 2 OH adalah molekul polar kecil, sehingga larut dalam air polar.

S1
Larutan dikatakan larutan cair apabila?
S2
Apa pembawa muatan dalam larutan cair?
S3
Isilah kolom kosong:
zat jenis apakah yang 100% larut dalam air untuk membentuk konsentrasi ion tinggi?
S4
Apa yang dimaksud elektrolit lemah?
S5
Mana yang memiliki kelarutan terendah dalam air?
S6
Sebuah elektrolit kuat dilarutkan dalam air. Manakah dari pernyataan berikut yang benar?
- Akan mempunyai konsentrasi ion yang rendah.
- Akan mengandung listrik.
- Akan terionisasi sebagian.
- Mengandung molekul.
- Akan terionisasi sepenuhnya.
- Mempunyai konsentrasi ion tinggi.
S7
Apa alasan untuk mengklasifikasikan gula sebagai non-elektrolit?
S8
Bagaimana kamu bisa membuat air menjadi konduktor listrik yang baik?
S9
Susun alkohol sesuai urutan kelarutannya dalam air.
S10
Manakah dari pernyataan berikut tidak benar?
- Sebuah non-elektrolit menghasilkan larutan elektrolit.
- Zat yang mengalami ionisasi sempurna dalam air adalah elektrolit kuat.
- Larutan cair memiliki pelarut non-polar.
- Zat yang benar-benar larut dalam air pasti menjadi elektrolit kuat.
- Elektrolit lemah menghasilkan hanya sedikit ion .
Tags:
Contoh Soal Kimia







