Contoh Soal Pendahuluan Reaksi Reversibel
Contoh Soal Pendahuluan Reaksi Reversibel -Reaksi kimia dapat dibagi menjadi satu arah (ireversibel) dan dua arah (reversible). Reaksi kimia yang bergerak pada satu arah disebut reaksi satu arah. Reaksi ini terjadi berkelanjutan sampai konsentrasi salah satu reaktan mencapai angka nol.
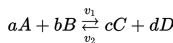
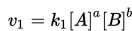
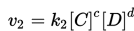
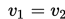
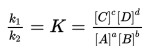
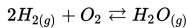
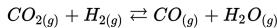
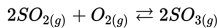
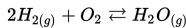
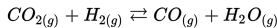
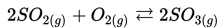
Misalnya : Pembakaran merupakan reaksi satu arah. Ketika batubara telah habis reaksi terhenti, atau pada saat oksigen menipis reaksi juga akan terhenti.
Sejumlah besar reaksi terjadi secara simultan pada dua arah, dan reaksi ini disebut reaksi reversibel (dua arah). Reaksi reversibel terdiri dari dua reaksi:
a). reaksi langsung yang menunjukkan pembuatan produk dari reaktan
b). reaksi tidak langsung yang menunjukkan pembuatan reaktan awal dari produknya
Contoh dari reaksi reversibel adalah:
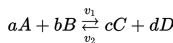
A dan B adalah reaktan, C dan D adalah hasil (produk) dari reaksi, v1 adalah kecepatan reaksi langsung, v2 adalah kecepatan reaksi tidak langsung. a, b, c, d adalah koefisien stoikiometrik.
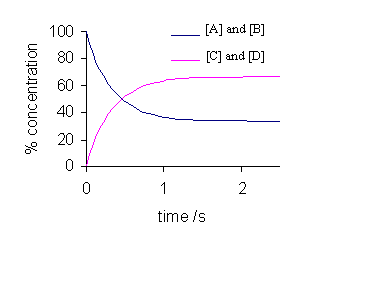
Pada awal reaksi, konsentrasi reaktan berada pada level maksimum dan kecepatan reaksi kimia langsung (v1) berada pada posisi paling tinggi:
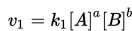
Jadi, pada awal reaksi v1>v2. Setelah waktu berjalan, terdapat perubahan pada konsentrasi reaktan. Konsentrasi reaktan mengalami penurunan, dan konsentrasi dari hasil reaksi justru meningkat. Oleh karena itu kecepatan reaksi kimia langsung (v1) menurun dan kecepatan reaksi tidak langsung mengalami peningkatan:
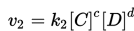
Ketika kecepatan reaksi langsung dan tidak langsung adalah sama, maka terdapat ekuilibrium dinamis di dalam sistem.
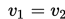
Hukum aksi massa menjelaskan kebiasaan larutan pada ekuilibrium dinamis. Pada temperatur konstan, laju reaksi berbanding setara dengan hasil konsentrasi reaktan. Hukum aksi massa ditunjukkan dalam persamaan berikut:
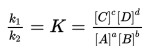
K adalah konstanta kesetimbangan dan dipengaruhi oleh keadaan reaktan dan temperatur. Jika bilangan jumlah K lebih besar, maka lebih besar pula konsentrasi hasil reaksi pada ekuilibrium.
Jika:
K=1 dan kecepatan reaksi langsung dan tidak langsung adalah sama.
K>1, maka kecepatan reaksi langsung lebih tinggi daripada kecepatan reaksi tidak langsung.
K<1, maka kecepatan reaksi tidak langsung lebih tinggi daripada kecepatan reaksi langsung.
Jika konstanta kesetimbangan memiliki bilangan kecil, maka reaksi akan sulit terjadi..
Jika konstanta kesetimbangan memiliki bilangan besar, maka reaksi akan terjadi lebih mudah.
Contoh dari reaksi reversibel adalah:
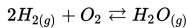
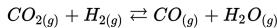
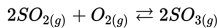

S1
Apakah nama reaksi yang bergerak pada satu arah?
S2
Reaksi reversibel terdiri dari _____.
S3
Pada awal reaksi, konsentrasi reaktan adalah _____.
S4
jika v1 adalah laju reaksi langsung dan v2 adalah laju reaksi tidak langsung, serta diketahui bahwa reaksi reversibel ini berada dalam ekuilibrium dinamis, manakah pernyataan paling tepat di bawah ini?
S5
Manakah definisi yang tepat tentang Hukum Aksi Massa?
S6
Jika konstanta kesetimbangan (K) sama dengan 1 (K=1),
maka realsi antara laju reaksi langsung (v1) dan laju reaksi tidak langsung (v2) adalah _____
maka realsi antara laju reaksi langsung (v1) dan laju reaksi tidak langsung (v2) adalah _____
S7
Jika konstanta kesetimbangan (K) lebih besar daripada 1 (K>1), maka relasi antara laju reaksi langsung (v1) dan laju reaksi tidak langsung (v2) adalah _____.
S8
Lengkapilah pernyataan berikut:
Konsentrasi reaktan pada reaksi reversibel _____, seiring berjalannya waktu.
Konsentrasi reaktan pada reaksi reversibel _____, seiring berjalannya waktu.
S9
Jika konstanta kesetimbangan memiliki bilangan kecil, maka reaksi _____.
S10
Manakah dari reaksi berikut yang merupakan reaksi reversibel?
a)
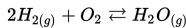
b)
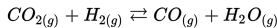
c)
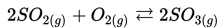
Tags:
Contoh Soal Kimia


