Contoh Soal Potensial Sel
Contoh Soal Potensial Sel - Pada topik sebelumnya, kalian telah belajar tentang sel volta. Sel volta merupakan suatu elemen yang berisi zat-zat kimia yang bereaksi redoks spontan untuk menghasilkan listrik. Pada topik ini, kita akan mempelajari tentang potensial sel. Apa itu potensial sel? Apa hubungannya dengan sel volta? Pada topik ini, kita akan mempelajarinya. Yuk simak dengan saksama.

Apakah kalian masih ingat dengan gambar di atas? Ya, kalian telah melihatnya pada topik sebelumnya. Gambar tersebut merupakan reaksi logam Na dengan air yang menghasilkan ledakan. Sebagaimana yang kita ketahui, reaksi antara Na dengan air merupakan reaksi redoks spontan. Reaksi ini menghasilkan energi dalam bentuk panas/api. Bukan hanya reaksi antara Na dengan air yang menghasilkan energi, masih banyak reaksi-reaksi lain yang juga berlangsung secara spontan dan menghasilkan energi. Lantas, apa hubungannya reaksi spontan dengan potensial sel yang akan kita pelajari pada topik ini? Mari kita simak ulasan berikut.
A. Potensial Sel
Pada topik sebelumnya, telah kita ketahui bahwa sel volta merupakan reaksi redoks spontan zat-zat kimia yang menghasilkan listrik. Jumlah listrik yang dihasilkan oleh reaksi redoks spontan dalam suatu sel volta inilah yang disebut sebagai potensial sel. Potensial sel disimbolkan sebagai Esel dengan satuan volt (V). Potensial sel dapat bernilai:
- Esel > 0 : proses spontan, menghasilkan listrik
- Esel < 0 : proses tidak spontan, tidak menghasilkan listrik
- Esel = 0 : proses setimbang, sel berhenti bekerja
Potensial sel yang diukur pada keadaan standar disebut sebagai potensial sel standar (E°). Keadaan standar tersebut berupa:
- suhu sebesar 25 °C
- tekanan gas = 1 atm
- konsentrasi ion-ion = 1 M
- elektrode berupa padatan murni
B. Potensial Elektrode Standar (E°)
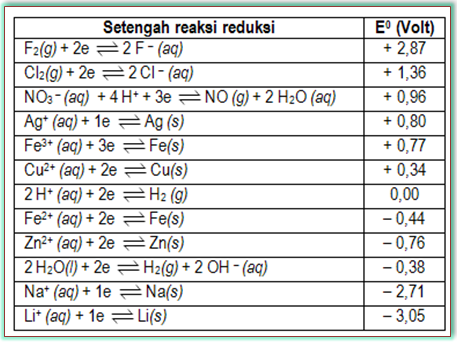
Potensial elektrode standar merupakan potensial pada setengah reaksi dalam keadaan standar. Potensial elektrode standar merupakan energi listrik yang terlibat dalam setengah reaksi reduksi atau setengah reaksi oksidasi suatu zat pada keadaan standar. Menurut kesepakatan para ilmuan, potensial elektrode standar yang digunakan adalah potensial setengah reaksi reduksi, yang selanjutnya disebut sebagai potensial reduksi atau potensial elektrode standar. Adapun potensial oksidasi sama nilainya dengan potensial reduksi, hanya tandanya yang berlawanan. Berikut ini, nilai potensial elektrode standar beberapa logam.

Semakin tinggi nilai potensial elektrode standar suatu zat, semakin mudah zat tersebut mengalami reduksi (semakin bersifat oksidator kuat). Sebaliknya, semakin rendah nilai potensial elektrode standar, semakin susah zat tersebut tereduksi, tetapi semakin mudah teroksidasi (semakin bersifat reduktor kuat).
C. Perhitungan Potensial Sel
Potensial sel dapat ditentukan melalui percobaan dengan menggunakan Voltmeter atau Potensiometer. Potensial sel juga dapat dihitung berdasarkan potensial elektrode dengan menggunakan perumusan:
Katode merupakan elektrode dengan harga E° yang lebih besar, sedangkan anode mempunyai harga E° yang lebih kecil.
Contoh soal
Diketahui potensial elektrode Fe dan Zn sebagai berikut:
Fe²⁺ + 2e ⇌ Fe E° = -0,44 V
Zn²⁺ + 2e ⇌ Zn E° = -0,76
Harga potensial sel yang dihasilkan adalah .…
Penyelesaian:
Diketahui:
Potensial elektrode : Fe²⁺ + 2e ⇌ Fe E° = -0,44 V
Potensial elektrode : Zn²⁺ + 2e ⇌ Zn E° = -0,76
Ditanyakan: E°sel = ... ?
Dijawab:
Katode merupakan elektrode dengan harga E° yang lebih besar, sedangkan anode mempunyai harga E° yang lebih kecil. Oleh karena potensial sel Fe > potensial Zn, maka Fe bertindak sebagai katode, sedangkan Zn sebagai anode, sehingga:
E_{sel}^0 = + 0,32{\rm{ volt}}
Perhitungan diatas dapat pula dilakukan dengan cara:
Reduksi: Fe²⁺ + 2e ⇌ Fe E° = -0,44 V
Oksidasi: Zn ⇌ Zn²⁺ + 2e E° = + 0,76 V +
Reaksi sel : Fe²⁺ + Zn ⇌ Zn²⁺ + Fe E°sel = + 0,32 V
Jadi, potensial sel yang dihasilkan adalah sebesar + 0,32 volt.
S1
Pernyataan yang benar tentang potensial sel adalah .…
S2
Diketahui potensial elektrode zat:
Sn²⁺ + 2e ⇌ Sn E° = -0,14 V
Mg²⁺ + 2e ⇌ Mg E° = -2,37 V
Jika disusun menjadi sel volta, nilai potensial sel dan logam yang bertindak sebagai katode adalah .…
S3
Notasi sel volta yang dapat disusun dari potensial elektrode di bawah ini adalah ....
Cr³⁺ + 3e ⇌ Cr E° = -0,74 V
Zn²⁺ + 2e ⇌ Zn E° = -0,76 V
S4
Jika diketahui:
potensial sel 2Br⁻ + F₂ → Br₂ + 2Fe⁻, E°sel = + 1, 80 V ; dan
potensial elektrode F₂ + 2e ⇌ 2F⁻ sebesar +2,87 volt.
Nilai potensial sel Br adalah ….
S5
Diketahui 2 buah potensial elektrode standar zat sebagai berikut:
Ni²⁺ + 2e ⇌ Ni E° = -0,28 V
Cd²⁺ + 2e ⇌ Cd E° = -0,40 V
Pada percobaan di atas, tidak dihasilkan listrik. Setelah diteliti, ternyata terdapat kesalahan pada jenis anodenya. Logam yang tidak tepat dipasang sebagai anode tersebut adalah ....
S6
Dari potensial elektrode-elektrode di bawah ini, pasangan elektrode dengan nilai potensial sel tertinggi adalah ....
Co²⁺ + 2e ⇌ Co E° = -0,28 V
Ca²⁺ + 2e ⇌ Ca E° = -2,87 V
Cr³⁺ + 3e ⇌ Cr E° = -0,74 V
S7
Berikut ini merupakan pernyataan tentang potensial sel standar.
- Diukur pada suhu 25 °C
- Konsentrasi zat 2 M
- Tekanan sebesar 1 atm
- Elektrode berupa padatan murni
Pernyataan yang benar terdapat pada nomor .…
S8
Nama alat ukur potensial sel adalah .…
S9
Potensial elektrode dari zat A yang bertindak sebagai anode adalah + 0,97 V. Agar terbentuk sel dalam keadaan setimbang, maka potensial reduksi zat lain yang diperlukan harus bernilai .…
S10
Diketahui:
Mn²⁺ + 2e ⇌ Mn E° = -1,18 V
Hg²⁺ + 2e ⇌ Hg E° = +0,97 V
Pernyataan yang benar tentang potensial elektrode di atas adalah .…
Tags:
Contoh Soal Kimia


